La insulina
La insulina es una hormona polipeptídica sintetizada por las células β de los islotes de Langerhans en el páncreas. En su forma activa consta de dos cadenas polipeptídicas: la A, de 20 aminoácidos y la B, de 31. Estas dos cadenas se unen entre sí por medio de dos puentes disulfuro. La insulina se sintetiza como preproinsulina. Esta molécula está formada por una sola cadena polipeptídica, que posteriormente y en diversas partes de la célula, sufre varios procesamientos para obtener finalmente la insulina activa (pérdida del péptido señal y eliminación del péptido C o conector).

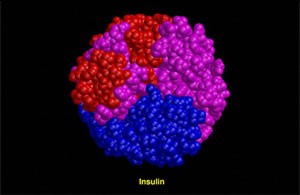
Cadenas de insulina (arriba) y estructura 3D de la molécula de insulina (abajo). Ambas tomadas de https://235.stem.org.uk/Diabetes/diabetes_16plus/diabetes_16plus5.html
¿Para qué vale?
La insulina es una hormona reguladora del nivel de glucosa en sangre (glucemia). Nuestras células requieren energía para realizar sus procesos. La glucosa es la principal fuente de energía para el cuerpo. Obtenemos glucosa de los alimentos, que, por medio de la digestión son convertidos en nutrientes, entre los que está la glucosa.
La insulina se secreta cuando hay hiperglucemia. Es decir, cuando en nuestra sangre hay mucha glucosa. Lo que suele ocurrir después de comer. La insulina provoca la captación (la entrada), almacenamiento y consumo de la glucosa en casi todos los tejidos del cuerpo, pero sobre todo en músculos, tejido adiposo e hígado. Así, en el hígado, la insulina facilita la entrada de glucosa en las células hepáticas, evita la liberación de glucosa a sangre y promueve la síntesis de glucógeno. En el músculo incrementa el transporte de glucosa hacia el interior de las células musculares (donde posteriormente podrá consumirse para obtener energía en forma de ATP). En el tejido adiposo la insulina promueve, indirectamente, el depósito de grasas en forma de triglicéridos.
Con todo esto, la glucemia disminuye a valores de normoglucemia (70-100 mg/dl en ayunas), y así se elimina la señal que provocó la síntesis de insulina y ésta deja de secretarse.
La acumulación de glucógeno en el hígado y de grasas en el tejido adiposo permite que el cuerpo tenga reservas de energía que poco a poco consumen durante el tiempo de ayunas para mantener una glucemia constante.
La regulación del metabolismo de la glucosa por la insulina depende de un equilibrio muy delicado con otra hormona “hermana”, el glucagón, del que puede que hablaremos en otro post.
Aparte de estos efectos metabólicos, esta hormona ejerce otras actividades relacionadas con factores de crecimiento de las que no vamos a hablar en esta ocasión.
Diabetes
Diabetes es aquella situación en la que los niveles de glucosa en la sangre están aumentados y la insulina no puede regularlos. Esto puede deberse a dos razones, que no haya suficiente insulina, o que el cuerpo no responda a la insulina.
Diabetes tipo 1: solía conocerse como diabetes juvenil porque suele presentarse en niños y adultos jóvenes. Se debe a que el sistema inmunitario destruye las células beta del páncreas y el cuerpo no puede producir insulina. Estos enfermos necesitan inyecciones de insulina para asimilar la glucosa y tener una vida normal.
Diabetes tipo 2: es la anteriormente llamada diabetes del adulto en oposición a la diabetes tipo I o juvenil, ya que este tipo de diabetes suele presentarse en personas adultas. Se debe a que el cuerpo presenta una resistencia a la insulina y suele ir acompañada de obesidad. La resistencia a la insulina se produce cuando el cuerpo necesita secretar más insulina de la normal para asimilar la glucosa y los niveles de insulina y glucosa no descienden durante los periodos de ayuno. Esta presencia continua de altos niveles de insulina hace que el cuerpo no responda a la hormona. Estos pacientes no necesitan inyecciones de insulina, ya que la producen, si no que necesitan disminuir la glucosa presente en el torrente sanguíneo, y eso lo consiguen a través de dieta, ejercicio y medicación (normalmente antidiabéticos orales).
Diabetes gestacional: este es un tipo de diabetes particular, que se desarrolla durante el embarazo. Por razones que no se conocen completamente, la madre presenta resistencia a la insulina. Normalmente, una vez después del parto esta diabetes desaparece aunque parece ser que predispone para un posterior desarrollo de diabetes tipo 2.
Descubrimiento
Pese a la existencia de ciertas discrepancias en cuanto a los científicos involucrados, podemos afirmar que la insulina se descubrió en 1921. Frederick Banting, médico canadiense, empezó a interesarse por la diabetes dos años antes, en 1919. En esa época ya se sabía que la diabetes era provocada por la deficiencia de una hormona secretada por los islotes del páncreas, pero no se había logrado aislar dicha hormona. En el laboratorio del profesor MacLeod, de la Universidad de Toronto y que no creía mucho en las ideas de Banting, y con la ayuda del estudiante de medicina estadounidense Charles Best intentaron durante el verano de 1921 aislar la proteína. Trabajaron con perros, y lograron demostrar que al extirpar el páncreas los animales aumentaban su glucemia y comenzaban a beber mucha agua y a debilitarse. No era sino un modelo animal rudimentario de diabetes. Posteriormente, comprobaron que tras la administración del extracto de páncreas libre de tripsina obtenido en otros perros tras ligar el conducto pancreático, los síntomas de diabetes desaparecieron. Habían descubierto la insulina. Para aumentar las pruebas necesitaban muchos más páncreas de los que podían obtener de los perros, así que empezaron a usar terneros.
Con la ayuda del doctor James Collip lograron purificar la insulina a un nivel suficiente como para probarla en humanos. Así, en 1922, se hicieron los primeros ensayos en humanos. El primer paciente fue un niño de 14 años, Leonard Thompson, que estaba a punto de morir por culpa de la diabetes. La insulina bovina que recibió era aún muy impura por lo que sufrió una fuerte reacción en el sitio donde se le aplicó la inyección. Aún así, recuperó rápidamente las fuerzas y el apetito y salvó su vida gracias a la insulina. El extracto de insulina se siguió probando en cada vez más pacientes, con bastante éxito. Hay que tener en cuenta que hasta ese año el único tratamiento disponible para los diabéticos era el control de la dieta.

Como consecuencia de este descubrimiento, MacLeod y Banting recibieron en 1923 el Premio Nobel de Medicina. A Banting no le pareció justo que fuera MacLeod el que compartiera el premio con él en vez de Best. A modo de desagravio, repartió con Best la dotación económica del premio. MacLeod compartió el suyo con Collip.
Primera comercialización
El 30 de mayo de 1922, se firmó una colaboración entre la Universidad de Toronto, a la que los investigadores habían cedido los derechos de la insulina a Eli Lilly. El acuerdo estipulaba que el laboratorio se encargaría de la producción de insulina y se quedaría con los derechos exclusivos para toda América. Lilly aceptó que el término “insulina” se utilizara para la molécula genérica, mientras que ellos utilizarían “Iletin” para la insulina que comercializaron desde 1923. George Walden, químico investigador de Lilly, desarrolló un método de purificación más avanzado, que permitió que se pudiera fabricar la insulina a gran escala, logrando asimismo un considerable aumento de la estabilidad y la pureza. Gracias a ello se pudo lanzar al mercado, en primer lugar en Canadá y Estados Unidos. Lleva por tanto casi 95 años en el mercado. Es importante recalcar que se trataba de insulina procedente de ganado bovino y porcino. En Europa la fábrica alemana de colorante Hoechst fue la primera en producirla. Sin embargo, la danesa Novo entró en el mercado en 1925 y muy pronto se hizo con el liderato en Europa.

La insulina animal presentaba varios problemas, fundamentalmente su elevado precio, derivado entre otras cosa de que para cubrir sus necesidades anuales, un diabético necesitaba los páncreas de aproximadamente 50 cerdos. En la época de máxima producción, Hoechts procesaba diariamente 11 toneladas de páncreas de cerdo procedentes de más de 100 000 animales, por lo tanto el tratamiento solo estaba al alcance de unos pocos. Por otra parte, hay que saber que la insulina de cerdo se diferencia de la humana en un aminoácido y la de bovino en tres. Esta diferencia es suficiente para que algunos pacientes desarrollaran alergia y debieran abandonar el tratamiento.
Primera evolución: prolongar la acción de la insulina
Por otra parte se necesitaban varias inyecciones diarias, por lo que enseguida los investigadores se dieron cuenta de que había que prolongar la duración de su acción. Hay que tener en cuenta que la insulina humana presenta un inicio de la acción de 30 minutos a una hora, un pico de efecto entre dos y cuatro horas, y la duración de su acción es de seis a ocho horas. En el año 1936 Hagedom y su equipo, del laboratorio danés Nordisk Insulin Laboratorium lograron combinar la insulina con protamina (una proteína de bajo peso molecular), haciendo que el inicio de su acción comenzara a la 1-2 horas, con un pico máximo a las 4-8 horas y una duración de 12 horas. Fue la primera insulina de acción retardada. Posteriormente se descubrió que la adición de zinc a la insulina con protamina prolongaba la duración de su actividad (más de 24 horas). Se administraba por la mañana y se complementaba con inyecciones adicionales de insulina regular.
Segunda evolución: combinación de insulinas
En 1946 Hagedom desarrolló la insulina NPH (Neutral Orotamine Hagedom), también llamada isophane. Es una variante de la mezcla insulina protamina zinc con una duración de efecto de 24 horas, pero que además podía ser mezclada con una parte de insulina “normal”, de acción rápida. Es una insulina “de acción intermedia”. En 1949 se lanzó al mercado y alcanzó gran popularidad en el uso clínico.
En la década de los 50 Hallas-Moller, de los laboratorios Novo, desarrolló la trilogía de las insulinas Lente, Semilente, Lente y Ultralente, combinadas con diferente proporción de zinc y mezcla de insulina amorfa y cristalina. Así, por ejemplo, la Lente original era una mezcla de insulina porcina amorfa y bovina cristalina. Según las mezclas de esas formas y el zinc, se conseguían distintos tiempos de acción y duración. Son las primeras de las denominadas insulinas lentas.
Descubrimiento de la secuencia y estructura
En 1955, el bioquímico inglés Frederick Sanger consigue establecer la composición y estructura de la insulina. Previamente había logrado determinar la secuecnia de aminoácidos y finalmente logró determinar cómo se unían las dos cadenas de las que hemos hablado al principio. La insulina la primera proteína secuenciada. Este trabajo le valió a Sanger el premio Nobel en 1958.

Aparición de antidiabéticos orales
En 1956 se lanzaron al mercado los primeros antidiabéticos orales, las sulfonamidas, como la archiconocida metformina. Aunque en este post se habla de la insulina, es importante citar otros avances en relación con la diabetes.
Insulina humana sintética
En la década de los 60 investigadores alemanes (Meinhofer y otros) trabajaron en la síntesis química de la insulina en laboratorio. Fue en 1975 en el laboratorio de la empresa Ciba-Geigy de Basilea cuando se logró sintetizar por primera vez insulina totalmente sintética.
Insulina recombinante
En 1973 Cohen y otros investigadores de la Universidad de California habían creado la primera bacteria transgénica, que expresaba un gen ajeno, que no era suyo. Obviamente eso llevaba a la idea intuitiva de que se podría introducir el gen de un péptido o una proteína que quisiéramos producir en masa en una bacteria, casi a demanda. Para eso, primero se necesita conocer el gen de la proteína o péptido que queremos producir. Bien, pues en 1978 W. Gilbert y Lydia Villa-Komaroff identificaron los genes responsables de la síntesis de la proinsulina. Sin embargo, aún faltaba por solventar un “pequeño” inconveniente técnico. La insulina se produce a partir de una única cadena que se corta en varios sitios hasta quedar convertida en dos cadenas unidas por los enlaces disulfuro. Las bacterias y las levaduras pueden sintetizar el precursor, pero no pueden procesarlo. La solución fue sintetizar las dos cadenas por separado y unirlas por métodos químicos.
Una vez logrado, se llevó a cabo el primer ensayo clínico, con 17 voluntarios en 1980, en el Guy’s Hospital de Londres. La primera insulina obtenida por la técnica de ADN recombinante fue aprobada por las autoridades reguladoras de Estados unidos en 1982. Se trataba de una insulina de acción corta, similar a la insulina humana natural. Fue producida y comercializada por el laboratorio Lilly bajo el nombre de Humulin. La insulina fue el primer producto comercial obtenido por clonación de genes.
Presentaba grandes ventajas: era más barata de producir, se podía producir a una escala mucho mayor y evitaba numerosos efectos secundarios de las insulinas animales empleadas anteriormente. Aunque mucha gente no lo quiera ver… esta insulina es producto de un TRANSGÉNICO. Sí, esos contra los que muchas voces claman porque son malísimos…
Análogos de insulina
A partir de la producción de la primera insulina recombinante, se trabajó en numerosas “nuevas insulinas recombinantes” mejoradas. Según las necesidades del paciente, y con pequeños cambios en la molécula, se pudo lograr que el efecto de la insulina fuera inmediato o persistente a lo largo del tiempo. Así, en 1996 se produjo el primer análogo de insulina de acción rápida. Se trataba de Humalog y fue desarrollado mediante una modificación de la secuencia de aminoácidos de la insulina humana. Con este pequeño cambio de posiciones se lograba aumentar la velocidad del efecto en los pacientes, por lo que era muy apropiado para el control de los niveles de glucemia después de las comidas.

Más tarde se observó que alargando una de las cadenas con dos aminoácidos y sustituyendo una glicina por una arginina se lograba una insulina poco soluble lo que provocaba que su efecto se alargara a lo largo del día. Es la denominada produjo la glargina, comercializada bajo la marca Lantus.

Actualmente toda la insulina que se encuentra en el mercado se sintetiza por técnicas de ingeniería genética.
En resumen…
La insulina fue el primer tratamiento eficaz para la diabetes. Desde que apareció en 1923 hasta 1982, es decir, durante ¡¡60 años!! los pacientes se inyectaban con insulinas de animales, más o menos modificadas para cambiar el momento en el que hacían efecto y cuánto duraba éste. Se trataba de un tratamiento carísimo, solo al alcance de unos pocos. Desde 1982 hasta la actualidad hemos vivido la era de la insulina recombinante (y los antidiabéticos orales), en la que la insulina se ha hecho accesible a todo el mundo, gracias a la tecnología de los transgénicos. Paralelamente se han ido también desarrollando insulinas más optimizadas en relación con las necesidades de cada paciente (distinta duración de acción y potencia del efecto). Simultáneamente los diabéticos han visto llegar muchos más avances para el tratamiento de su enfermedad. Pese a que, en muchas ocasiones les parece que no se avanza en el tratamiento y la curación de su enfermedad, lo cierto es que los avances son continuos… aunque, obviamente, no todo lo rápido que desearíamos todos.
Este artículo ha sido escrito por Alberto Morán y Yolanda Otero.
6 Comments
Leave A Comment Cancelar la respuesta
Este sitio usa Akismet para reducir el spam. Aprende cómo se procesan los datos de tus comentarios.








Excelente artículo muchas gracias, por la información me sirvió mucho
Gracias por tu comentario.
[…] “La insulina”. https://www.dciencia.es/la-insulina/. […]
la insulina al igual que la diabetes y el covid son inventos de la ciencia, antes del 1900 la daibetes no existia ahora haste es hereditaria lo mismo con el covid este llegara a ser hereditario pues las vacunas modificaran nuestros genes
Como se extrae la insulina de los intestinos del cerdo para ser aprovechadas por el ser humano
Aquí tienes el artículo de 1923 en el que se describe cómo se hacía la obtención y se explica todo el proceso químico: https://www.sciencedirect.com/science/article/pii/S0021925818854825/pdf?md5=78a83d354f0f1c0f662aa85dfe44599c&pid=1-s2.0-S0021925818854825-main.pdf
De todas maneras, recuerda que desde hace 40 años ya no se extrae de cerdos, sino que se fabrica en bacterias